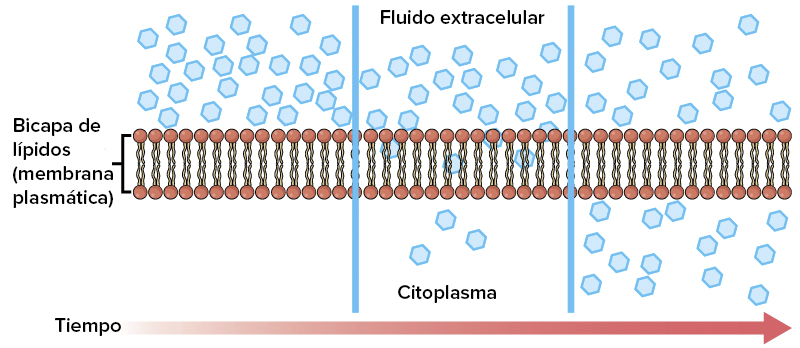
La función de la circulación consiste en atender las necesidades del organismo: transportar nutrientes hacia los tejidos del organismo, transportar los productos de desecho, transportar las hormonas de una parte del organismo a otra y, en general, mantener un entorno apropiado en todos los líquidos tisulares del organismo para lograr la supervivencia y una funcionalidad óptima de las células. La velocidad del flujo sanguíneo en muchos de los tejidos se controla principalmente en respuesta a su necesidad de nutrientes. En algunos órganos, como los riñones, la circulación sirve para funciones adicionales.
CARACTERÍSTICAS FÍSICAS DE LA CIRCULACIÓN.

La circulación, está divida en circulación sistémica y circulación pulmonar. Como la circulación sistémica aporta el flujo sanguíneo a todos los tejidos del organismo excepto los pulmones, también se conoce como circulación mayor o circulación periférica.
Componentes funcionales de la circulación
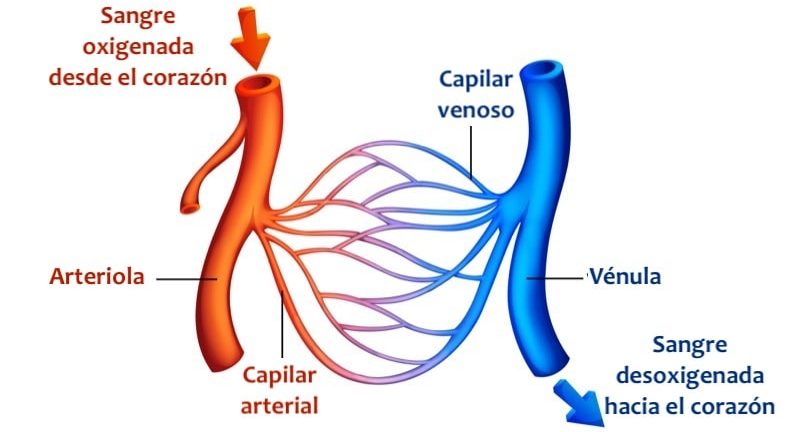
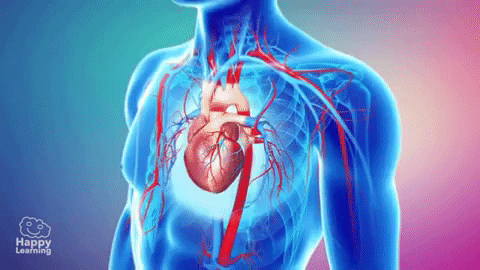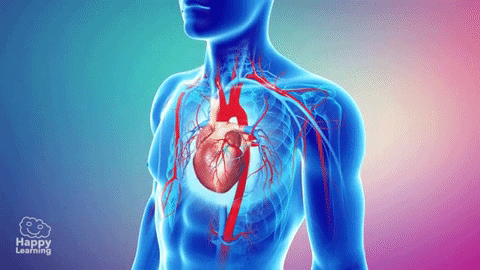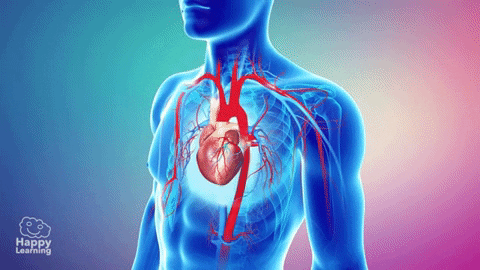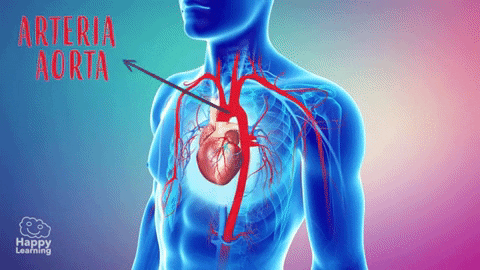
La función de las arterias consiste en transportar la sangre con una presión alta hacia los tejidos, motivo por el cual las arterias tienen unas paredes vasculares fuertes y unos flujos sanguíneos importantes con una velocidad alta. Las arteriolas son las últimas ramas pequeñas del sistema arterial y actúan controlando los conductos a través de los cuales se libera la sangre en los capilares. Las arteriolas tienen paredes musculares fuertes que pueden cerrarlas por completo o que pueden, al relajarse, dilatar los vasos varias veces, con lo que pueden alterar mucho el flujo sanguíneo en cada lecho tisular en respuesta a sus necesidades.
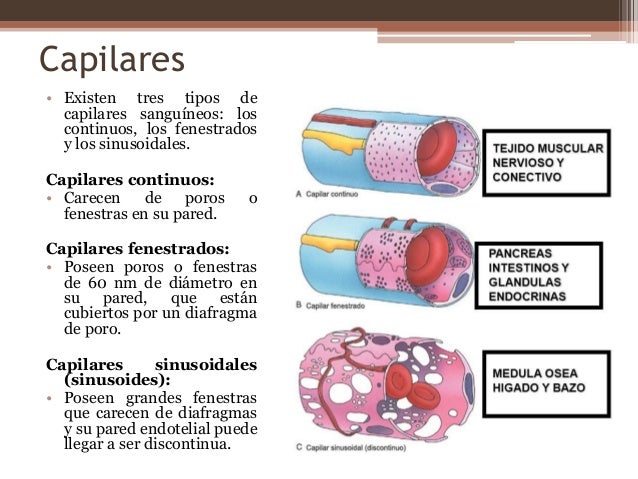
La función de los capilares consiste en el intercambio de líquidos, nutrientes, electrólitos, hormonas y otras sustancias en la sangre y en el líquido intersticial. Para cumplir esta función, las paredes del capilar son finas y tienen muchos poros capilares diminutos, que son permeables al agua y a otras moléculas pequeñas. Las vénulas recogen la sangre de los capilares y después se reúnen gradualmente formando venas de tamaño progresivamente mayor. Las venas funcionan como conductos para el transporte de sangre que vuelve desde las vénulas al corazón; igualmente importante es que sirven como una reserva importante de sangre extra.
Volúmenes de sangre en los distintos componentes de la circulación
Una visión general de la circulación junto con los porcentajes del volumen de sangre total en los segmentos principales de la circulación. Por ejemplo, aproximadamente el 84% de todo el volumen de sangre del organismo se encuentra en la circulación sistémica y el 16% en el corazón y los pulmones. Del 84% que está en la circulación sistémica, aproximadamente el 64% está en las venas, el 13% en las arterias y el 7% en las arteriolas y capilares sistémicos. El corazón contiene el 7% de la sangre, y los vasos pulmonares, el 9%. El bajo volumen de sangre que hay en los capilares, aunque es allí donde se produce la función más importante de la circulación, la difusión de las sustancias que entran y salen entre la sangre y los tejidos.

Superficies transversales y velocidades del flujo sanguíneo
Vaso Superficie transversal (cm2) Aorta 2,5 Pequeñas arterias 20 Arteriolas 40 Capilares 2.500 Vénulas 250 Pequeñas venas 80 Venas cavas 8

Es decir, en condiciones de reposo la velocidad es como media de 33 cm/s en la aorta pero con una velocidad solo de 1/1.000 en los capilares, es decir, aproximadamente 0,3 mm/s. No obstante, como los capilares tienen una longitud de solo 0,3 a 1 mm, la sangre solo se queda allí durante 1-3 s, un hecho sorprendente, porque toda la difusión de los nutrientes y electrólitos que tiene lugar a través de la pared capilar debe realizarse en este tiempo tan corto. Presiones en las distintas porciones de la circulación Como el corazón bombea la sangre continuamente hacia la aorta, la presión media en este vaso es alta, con una media en torno a los 100 mmHg. Además, como el bombeo cardíaco es pulsátil, la presión arterial alterna entre una presión sistólica de 120 mmHg y una diastólica de 80 mmHg.
A medida que el flujo sanguíneo atraviesa la circulación sistémica, la presión media va cayendo progresivamente hasta llegar casi a 0 mmHg en el momento en el que alcanza la terminación de las venas cava superior e inferior, donde se vacía en la aurícula derecha del corazón
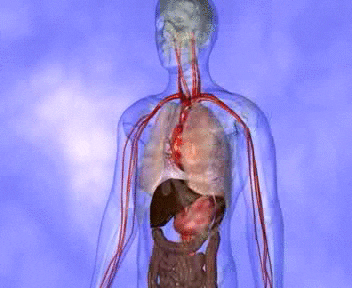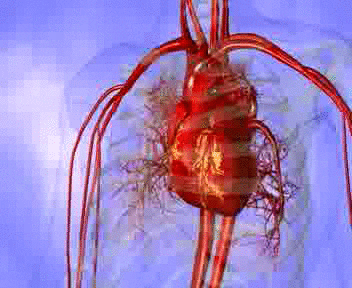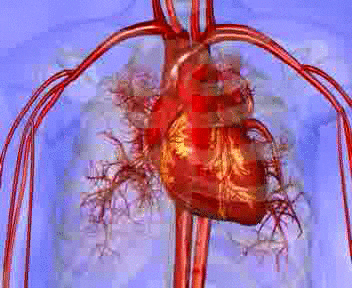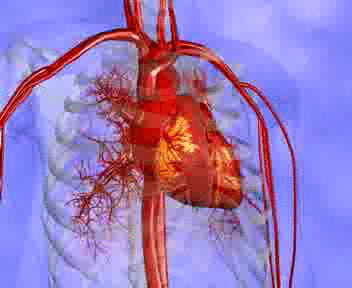
La presión de los capilares sistémicos oscila desde 35 mmHg cerca de los extremos arteriolares hasta tan solo 10 mmHg cerca de los extremos venosos, pero la presión media «funcional» en la mayoría de los lechos vasculares es de 17 mmHg, aproximadamente, una presión suficientemente baja que permite pequeñas fugas de plasma a través de los poros diminutos de las paredes capilares, aunque los nutrientes pueden difundir fácilmente a través de los mismos poros hacia las células de los tejidos externos. Se ven las presiones respectivas en los distintos componentes de la circulación pulmonar. En las arterias pulmonares la presión es pulsátil, igual que en la aorta, pero la presión es bastante menor: la presión sistólica arterial pulmonar alcanza un promedio de 25 mmHg, y la diastólica, de 8 mmHg, con una presión arterial pulmonar media de solo 16 mmHg. La media de la presión capilar pulmonar alcanza un promedio de solo 7 mmHg. Aun así, el flujo sanguíneo por minuto a través de los pulmones es el mismo que en la circulación sistémica. Las bajas presiones del sistema pulmonar coinciden con las necesidades de los pulmones, ya que lo único que se necesita es la exposición de la sangre en los capilares pulmonares al oxígeno y otros gases en los alvéolos pulmonares.
PRINCIPIOS BÁSICOS DE LA FUNCIÓN CIRCULATORIA
Aunque la función circulatoria es muy compleja, hay tres principios básicos que subyacen en todas las funciones del sistema.
- El flujo sanguíneo en la mayoría de los tejidos está controlado según la necesidad tisular. Cuando los tejidos son activos necesitan un aporte mucho mayor de nutrientes y, por tanto, un flujo sanguíneo mucho mayor que en reposo, en ocasiones hasta 20 o 30 veces el nivel de reposo, a pesar de que el corazón normalmente no puede aumentar su gasto cardíaco en más de 4-7 veces su gasto cardíaco por encima del nivel en reposo. Por tanto, no es posible aumentar simplemente el flujo sanguíneo en todo el organismo cuando un tejido en particular demanda el aumento del flujo. Por el contrario, la microvasculatura de cada tejido vigila continuamente las necesidades de su territorio, así como la disponibilidad de oxígeno y de otros nutrientes y la acumulación de dióxido de carbono y de otros residuos, y, a su vez, estos microvasos actúan directamente sobre los vasos sanguíneos locales, dilatándolos y contrayéndolos, para controlar el flujo sanguíneo local con precisión hasta el nivel requerido para la actividad tisular. Además, el control nervioso de la circulación desde el sistema nervioso central y las hormonas también colaboran en el control del flujo sanguíneo tisular.
- El gasto cardíaco es la suma de todos los flujos locales de los tejidos. Cuando el flujo sanguíneo atraviesa un tejido, inmediatamente vuelve al corazón a través de las venas y el corazón responde automáticamente a este aumento del flujo aferente de sangre bombeándolo inmediatamente hacia las arterias. Así, el corazón actúa como un autómata respondiendo a las necesidades de los tejidos. No obstante, a menudo necesita ayuda en forma de señales nerviosas especiales que le hagan bombear las cantidades necesarias del flujo sanguíneo.
- La regulación de la presión arterial es generalmente independiente del control del flujo sanguíneo local o del control del gasto cardíaco. El sistema circulatorio está dotado de un extenso sistema de control de la presión arterial.
INTERRELACIONES ENTRE LA PRESIÓN, EL FLUJO Y LA RESISTENCIA
El flujo sanguíneo que atraviesa un vaso sanguíneo está determinado por dos factores:
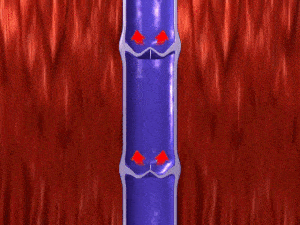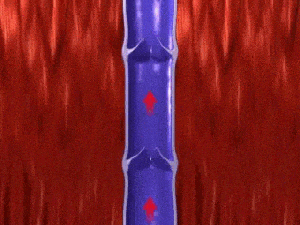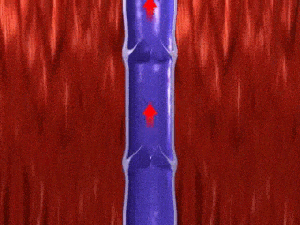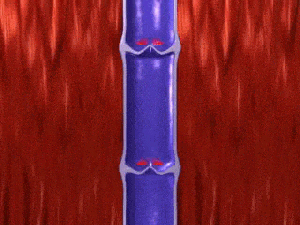
- Diferencia de presión de la sangre entre los dos extremos de un vaso, también denominado «gradiente de presión» en el vaso, que empuja la sangre a través del vaso.
- Los impedimentos que el flujo sanguíneo encuentra en el vaso, que se conoce como resistencia vascular.
El flujo a través del vaso se puede calcular con la fórmula siguiente, que se conoce como ley de Ohm:
Donde F es el flujo sanguíneo, ∆P es la diferencia de presión (P1 – P2) entre los dos extremos del vaso y R es la resistencia. En esta fórmula se afirma que el flujo sanguíneo es directamente proporcional a la diferencia de presión, pero inversamente proporcional a la resistencia. Obsérvese que es la diferencia de presión entre los dos extremos del vaso, y no la presión absoluta, la que determina la velocidad del flujo. Por ejemplo, si la presión de ambos extremos de un vaso es de 100 mmHg, es decir, sin diferencias entre ellos, no habrá flujo aunque la presión sea de 100 mmHg. La ley de Ohm, de la fórmula precedente, expresa las relaciones más importantes entre todas las que el lector debe conocer para entender la hemodinámica de la circulación. Debido a la gran importancia que tiene esta fórmula, también deberá familiarizarse con sus demás formas algebraicas:
FLUJO SANGUÍNEO
El flujo sanguíneo es, sencillamente, la cantidad de sangre que atraviesa un punto dado de la circulación en un período de tiempo determinado. Normalmente se expresa en mililitros por minuto o litros por minuto, pero puede expresarse en mililitros por segundo o en cualquier otra unidad del flujo y de tiempo. El flujo sanguíneo global de toda la circulación de un adulto en reposo es de unos 5.000 ml/min, cantidad que se considera igual al gasto cardíaco porque es la cantidad de sangre que bombea el corazón en la aorta en cada minuto.

Flujo de sangre laminar en los vasos
Cuando el flujo sanguíneo se mantiene en equilibrio a través de un vaso sanguíneo largo y liso, el flujo se produce de forma aerodinámica, manteniéndose cada capa de sangre a la misma distancia de la pared del vaso. Además, la porción de sangre más central se mantiene en el centro del vaso. Este tipo de flujo se conoce como flujo laminar o flujo aerodinámico y es el contrario del flujo turbulento, que es el flujo sanguíneo que transcurre en todas las direcciones del vaso y se mezcla continuamente en su interior, como veremos más adelante. Perfil de velocidad parabólica durante el flujo laminar Cuando se produce el flujo laminar, la velocidad del flujo en el centro del vaso es bastante mayor que la velocidad cerca de los bordes exteriores.
La causa de este perfil parabólico es la siguiente: las moléculas de líquido que tocan la pared se mueven lentamente por su adherencia a la pared del vaso. La siguiente capa de moléculas se desliza sobre ellas, la tercera capa sobre la segunda, la cuarta sobre la tercera, etc. Por tanto, el líquido de la parte central del vaso se puede mover rápidamente porque hay muchas capas de moléculas deslizantes entre la zona central del vaso y su pared, es decir, cada capa que se sitúa más hacia el centro fluye progresivamente con más rapidez que las capas más externas.
Flujo de sangre turbulento en algunas situaciones
Cuando la velocidad del flujo sanguíneo es demasiado grande, cuando atraviesa una obstrucción en un vaso, hace un giro brusco o pasa sobre una superficie rugosa, el flujo puede volverse turbulento o desordenado en lugar de aerodinámico (El flujo turbulento significa que el flujo sanguíneo atraviesa el vaso en dirección transversal y también longitudinal, formando espirales que se denominan corrientes en torbellino, similares a los remolinos que se ven con frecuencia en un río que fluye rápidamente en un punto de obstrucción. Cuando hay corrientes en torbellino el flujo sanguíneo encuentra una resistencia mucho mayor que cuando el flujo es aerodinámico, porque los torbellinos aumentan mucho la fricción global del flujo en el vaso. El flujo turbulento tiende a aumentar en proporción directa a la velocidad del flujo sanguíneo, al diámetro del vaso sanguíneo y a la densidad de la sangre y es inversamente proporcional a la viscosidad de la sangre, de acuerdo a la ecuación siguiente:
Donde Re es el número de Reynolds, una medida que da idea de la tendencia a producirse turbulencias, (υ es la velocidad media del flujo sanguíneo (en centímetros/segundo), d es el diámetro del vaso (en centímetros), ρ es la densidad y η es la viscosidad (en poises). La viscosidad de la sangre suele ser de 1/30 poise y la densidad es solo ligeramente mayor de 1, por lo que un aumento del número de Reynolds por encima de 200-400 indica que se producirá flujo turbulento en algunas ramas de los vasos, pero que se desvanecerá en las porciones más pequeñas de estos. No obstante, cuando el número de Reynolds ascienda por encima de 2.000 habrá turbulencias en todos los vasos rectos pequeños. El número de Reynolds del flujo en el sistema vascular suele aumentar en condiciones normales hasta 200-400 en las grandes arterias, es decir, casi siempre hay alguna turbulencia del flujo en las ramas de estos vasos. En las porciones proximales de la aorta y la arteria pulmonar el número de Reynolds puede aumentar a varios miles durante la fase rápida de eyección ventricular, lo que produce una turbulencia considerable en la zona proximal de la aorta y en la arteria pulmonar, donde hay muchas condiciones apropiadas para que haya turbulencias:
- Una velocidad elevada del flujo sanguíneo.
- La naturaleza pulsátil del número de Reynolds.
- El cambio brusco del diámetro del vaso.
- Un diámetro del vaso de gran calibre. No obstante, en los vasos pequeños el número de Reynolds casi nunca es bastante elevado como para provocar turbulencias.

PRESIÓN SANGUÍNEA
Unidades estándar de presión La presión sanguínea se mide casi siempre en milímetros de mercurio (mmHg) porque el manómetro de mercurio se ha usado como patrón de referencia para medir la presión desde su invención en 1846 por Poiseuille. En realidad, la presión arterial mide la fuerza ejercida por la sangre contra una unidad de superficie de la pared del vaso. Cuando se dice que la pared de un vaso es de 50 mmHg, quiere decirse que la fuerza ejercida es suficiente para empujar una columna de mercurio contra la
![Qué es Presión Sanguínea? » Su Definición y Significado [2020]](https://conceptodefinicion.de/wp-content/uploads/2017/12/Presi%C3%B3n_Sangu%C3%ADnea.jpg)
gravedad hasta una altura de 50 mm. Si la presión es de 100 mmHg, empujará la columna de mercurio hasta los 100 mm. En ocasiones, la presión se mide en centímetros de agua (cmH2O). Una presión de 10 cmH2O significa una presión suficiente para elevar una columna de agua contra la gravedad hasta una altura de 10 cm. Una presión de 1 mmHg es igual a una presión de 1,36 cmH2O, porque la densidad del mercurio es 13,6 veces mayor que la del agua y 1 cm es 10 veces mayor que 1 mm.
RESISTENCIA AL FLUJO SANGUÍNEO
Unidades de resistencia
La resistencia es el impedimento al flujo sanguíneo en un vaso, pero no se puede medir por medios directos. Por el contrario, la resistencia debe calcularse a partir de las determinaciones del flujo sanguíneo y de la diferencia de presión entre dos puntos del vaso. Si la diferencia de presión entre los dos puntos es de 1 mmHg y el flujo es de 1 ml/s, se dice que la resistencia es de una unidad de resistencia periférica, abreviada habitualmente como PRU.
Expresión de la resistencia en unidades CGS
En ocasiones se usa una unidad física básica en CGS (centímetros, gramos, segundos) para expresar la resistencia. Esta unidad es la dina · s/cm5.
Resistencia vascular periférica total y resistencia vascular pulmonar total
La velocidad del flujo sanguíneo a través de todo el sistema circulatorio es igual a la velocidad de la sangre que bombea el corazón, es decir, es igual al gasto cardíaco. En un ser humano adulto es aproximadamente igual a 100 ml/s. La diferencia de presión entre las arterias sistémicas y las venas sistémicas es de unos 100 mmHg. Por tanto, la resistencia de toda la circulación sistémica, que se denomina resistencia periférica total, es de 100/100 o 1 PRU. Cuando todos los vasos sanguíneos del organismo se contraen con fuerza la resistencia periférica total puede aumentar hasta 4 PRU, mientras que cuando se dilatan puede caer a tan solo 0,2 PRU. En el sistema pulmonar la presión arterial media es de 16 mmHg y la presión media en la aurícula izquierda es de 2 mmHg, con lo que la diferencia neta de presión es de 14 mm. Por tanto, cuando el gasto cardíaco es normal, en torno a 100 ml/s, se calcula que la resistencia vascular pulmonar total es de 0,14 PRU (la séptima parte que en la circulación sistémica).
La «conductancia» de la sangre en un vaso es inversa a la resistencia La conductancia es la medición del flujo sanguíneo a través de un vaso para dar una diferencia de presión dada. Esta medida se expresa en milímetros por segundo por milímetro de mercurio de presión, pero también se puede expresar en litros por segundo por milímetro de mercurio o en cualquier otra unidad del flujo sanguíneo y presión. Es evidente que la conductancia es el recíproco exacto de la resistencia según la ecuación:
Cambios pequeños en el diámetro de un vaso cambian mucho la conductancia Pequeños cambios en el diámetro de un vaso provocan cambios enormes en su capacidad de conducir la sangre cuando el flujo sanguíneo es aerodinámico. Este fenómeno se ilustra en el experimento de la figura 14-8A, en la que vemos tres vasos con diámetros relativos de 1, 2 y 4 pero con la misma diferencia de presión de 100 mmHg entre los dos extremos del vaso. Aunque los diámetros de estos vasos aumentan solo en cuatro veces, los flujos respectivos son de 1, 16 y 256 ml/min, es decir, un incremento del flujo de 256 veces: la conductancia del vaso aumenta en proporción a la cuarta potencia del diámetro.
Ley de Poiseuille
El anillo de sangre siguiente hacia el centro del vaso se desliza sobre el primero y, por tanto, fluye con mayor rapidez, al igual que los anillos tercero, cuarto, quinto y sexto, que también fluyen con velocidades crecientes. Es decir, la sangre que está cerca de la pared de los vasos fluye lentamente, mientras que la que está en el centro del vaso fluye mucho más rápidamente. En el vaso pequeño, esencialmente toda la sangre está cerca de la pared, por lo que, sencillamente, no existe un chorro central de sangre que fluya con gran rapidez. Al integrar las velocidades de todos los anillos concéntricos de la sangre en movimiento y multiplicarlos por las superficies de los anillos se puede obtener la fórmula siguiente, que representa la ley de Poiseuille:
En la que F es la velocidad del flujo sanguíneo, ∆P es la diferencia de presión entre los extremos del vaso, r es el radio del vaso, la es la longitud del vaso y η es la viscosidad de la sangre. Importancia de la «ley de la cuarta potencia» del diámetro del vaso para determinar la resistencia arteriolar En la circulación sistémica, aproximadamente dos tercios de toda la resistencia sistémica al flujo sanguíneo se debe a la resistencia arteriolar en las pequeñas arteriolas. Los diámetros internos de las arteriolas varían desde tan solo 4 μm hasta 25, aunque sus fuertes paredes vasculares permiten cambios enormes de los diámetros internos, a menudo hasta en cuatro veces. Como consecuencia de la ley de la cuarta potencia expuesta anteriormente, que relaciona el vaso sanguíneo con el diámetro del vaso, se puede ver que este incremento en cuatro veces del diámetro del vaso aumenta el flujo hasta en 256 veces, es decir, esta ley de cuarta potencia hace que sea posible que las arteriolas, que responden con solo pequeños cambios del diámetro a las señales nerviosas o a las señales químicas de los tejidos locales, hagan desaparecer casi completamente el flujo sanguíneo hacia el tejido o vayan al otro extremo, provocando un inmenso incremento del flujo.
Los vasos sanguíneos emiten numerosas ramas que forman circuitos paralelos que aportan la sangre a los distintos órganos y tejidos del organismo. Esta distribución paralela permite que cada tejido regule su propio flujo sanguíneo en mayor grado, independientemente del flujo de los demás tejidos.

Es evidente que, para un gradiente de resistencia dado, fluirán cantidades de sangre mucho mayores a través de este sistema paralelo que a través de cada uno de los vasos sanguíneos por separado, por lo que la resistencia total es bastante menor que la resistencia de cualquier vaso sanguíneo aislado. No obstante, el aumento de la resistencia de cualquiera de los vasos sanguíneos aumenta la resistencia vascular total. Puede parecer paradójico que al añadirse más vasos sanguíneos al circuito se reduzcan la resistencia vascular total. No obstante, si hay muchos vasos sanguíneos en paralelo será más sencillo que la sangre fluya a través del circuito porque cada vaso paralelo constituye otra vía o conductancia para el flujo sanguíneo.
Por ejemplo, las circulaciones cerebral, renal, muscular, gastrointestinal, cutánea y coronaria se distribuyen en paralelo y cada tejido contribuye a la conductancia global de la circulación sistémica. Efecto del hematocrito y de la viscosidad de la sangre sobre la resistencia vascular y el flujo sanguíneo. Cuanto mayor sea la viscosidad, menor será el flujo en un vaso si todos los demás factores se mantienen constantes. Además, la viscosidad de la sangre normal es tres veces mayor que la del agua. ¿Qué hace que la sangre sea tan viscosa? Principalmente, el gran número de eritrocitos suspendidos en la sangre, cada uno de los cuales ejerce un arrastre por fricción sobre las células adyacentes y contra la pared del vaso sanguíneo. Hematocrito: proporción de sangre compuesta por eritrocitos Si una persona tiene un hematocrito de 40 significa que el 40% del volumen sanguíneo está formado por las células y el resto es plasma. El hematocrito de un hombre adulto alcanza un promedio de 42, mientras que en las mujeres es de 38. Estos valores son muy variables, dependiendo de si la persona tiene anemia, del grado de actividad corporal y de la altitud en la que reside la persona. Estos cambios del hematocrito se comentan en relación con los eritrocitos y con su función del transporte del oxígeno. El hematocrito se determina centrifugando la sangre en un tubo calibrado. La calibración permite la lectura directa del porcentaje de células.
El aumento del hematocrito incrementa mucho la viscosidad de la sangre La viscosidad de la sangre aumenta drásticamente a medida que lo hace el hematocrito. La viscosidad de la sangre total con un hematocrito normal es de 3 a 4, lo que significa que se necesita tres veces más presión para obligar a la sangre total a atravesar un vaso que si fuera agua. Cuando el hematocrito aumenta hasta 60 o 70, como sucede en personas con policitemia, la viscosidad de la sangre puede ser hasta 10 veces mayor que la del agua y su flujo a través de los vasos sanguíneos se retrasa mucho.
Otros factores que afectan a la viscosidad de la sangre son la concentración y el tipo de las proteínas plasmáticas, pero estos efectos son mucho menores que el efecto del hematocrito, por lo que no son aspectos significativos en la mayoría de los estudios hemodinámicos. La viscosidad del plasma sanguíneo es 1,5 veces la del agua. Efectos de la presión sobre la resistencia vascular y el flujo sanguíneo tisular
La «autorregulación» atenúa el efecto de la presión arterial en el flujo sanguíneo tisular A partir de todo lo comentado, el incremento de la presión arterial debería provocar un incremento proporcional del flujo sanguíneo en los distintos tejidos del organismo, aunque el efecto de la presión arterial sobre el flujo sanguíneo en muchos tejidos suele ser bastante menor de lo que se podría esperar.


/sistema-linfatico-56a7efa85f9b58b7d0ef64a5.jpg)










![Qué es Sistema Nervioso Central? » Su Definición y Significado [2020]](https://conceptodefinicion.de/wp-content/uploads/2017/11/Sistema_Nervioso_Central.jpg)